关于临床前动物实验,资料显示,截至2012年7月,卫生部干细胞整顿工作办公室的调查结果是——干细胞已经在我国300家左右的医院、机构开展。而国家干细胞工程技术研究中心主任、中国医学科学院血液学研究所研究员韩忠朝认为,300家医疗机构是个保守的数字,“这是卫生部开展的一个自查,自己报上的有300家,还有没有报上去的呢?实际肯定不止300家做”。事实上,除了造血干细胞血液疾病以外,卫生部没有批准任何一家医疗机构用干细胞临床任何一种疾病,全球的绝大多数干细胞研究都在临床前动物实验或临床阶段,只有加拿大在2012年5月份批准了美国一家公司生产的干细胞药物用于移植物抗宿主病、日本ips细胞实验自去年来得到**支持。中成药临床前动物实验是什么;西藏靠谱临床前动物实验检测
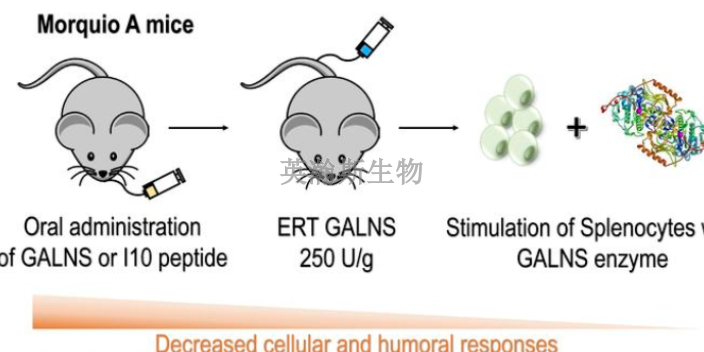
临床前动物实验就在英瀚斯一站式实验中心。凡是没有经过院方伦理委员会的审核,一般是不合乎规范的。合乎规范也颇值得琢磨。有的是法律,有的是行政管理,有的是行业认可的标准,比如针对临床的一些共识等。现在的问题是,没有一个统一的规范,也就很难定义违不违规了。对此,首先是要完善干细胞的基础研究,踏踏实实完成从临床前动物实验到临床试验的过程,不可急功近利。同时,技术需要创新和尝试,由此带来的风险要靠严格的规范去控制,但不能因为害怕承担可能的风险,使规则的制定都停滞不前。四川高质量临床前动物实验公司中成药临床前动物实验研究;
全国外科植入物与矫形器械标准化技术委员会组织工程医疗器械产品分技术委员会(sac/ tc110/sc3)组织制定了几项临床前动物实验研究相关的标准,即yy/t 0606.10-2008“组织工程医疗产品第10部分:修复或再生关节软骨的植入物体内评价指南”、yy/t 1575-2017“组织工程医疗器械产品修复和替代骨组织植入物骨形成活性的评价指南”、yy/t 1598-2018“组织工程医疗器械产品骨用于脊柱融合的外科植入物骨修复或再生评价试验指南”、yy/t 1636-2018“组织工程医疗器械产品体内临界尺寸骨缺损的临床前评价指南”。这些标准针对软骨和骨植入物的临床前动物实验研究,给出了实验动物的选择、观察周期及观察终点指标的确定等具体要求和指导。
临床前动物实验研究监测②中期观察:在动物从初始手术过程中恢复,监测器械相关风险期间,建议每天至少在喂食时间监测两次,以便在活动时观察它们。同时,建议咨询兽医并制定体重监测计划。应考虑将体重评分作为定期观察动物的辅助手段。如果研究涉及收集临床生化检测数据或更先进的诊断,建议制定标准操作规程以便在需要时指定一种不械的化学干预方法。③终期研究期:建议实验方案应包括终期研究的细节,并包括检查、采集和组织处理的所有方法。具体方案应包括终点检验的方法、完成放射线分析和成像分析的陈述(如果适用)、确定**终体重和机体评分的方法。④尸体解剖和评估:不良事件可能会出现在临床或亚临床期。因此,建议在研究中纳入的系统性尸检,包括组织收集和保存,以进行组织病理学检查。所得信息可协助确定不良事件与器械的相关性。英瀚斯是专业的化妆品临床前动物实验外包公司。

临床前动物实验除了《药物非临床研究质量管理规范》第十五至十七条对研究设备的基本要求之外,鉴于医疗器械动物实验研究通常非常复杂,其所用特殊设备可能会从委托方向合同研究机构转移,因此,建议委托方与顾问和专题负责人仔细研究实验中使用的合同设备保养、维护的相关知识。参与临床前动物实验研究计划的人员应与将实际实施研究的人员尽早进行频繁的交流,以确保研究设施拥有用于研究的适当辅助设备和资源。特殊设备的转移流程及认证、培训、使用应制定相应的sop,做好设备使用记录。英瀚斯专业做化学药药临床前动物实验外包。黑龙江个性化临床前动物实验检测
化药临床前动物实验包括哪些?西藏靠谱临床前动物实验检测
临床前动物实验,tgn1412是tegenero的较早产品,从生产到进入临床试验才2年多时间,从mhra批准tgn1412进入临床试验到试验开始总共才45天。esg指出,虽然临床前动物实验没有发现严重不良反应,但不能因此估测出一个tgn1412用于人类的安全剂量,药物的安全性未得到充分论证。实施临床试验的研究者没有受到良好培训,志愿者对可能发生的危险也了解不足。媒体和公众都指责mhra为了吸引医药公司到英国进行临床研究而放宽了药物临床研究的审批。从而使一家*有15名雇员、风险资本驱动的德国小公司不在本国进行临床试验,却转而选择英国。西藏靠谱临床前动物实验检测
